
随着全球人口老龄化的日益加剧,骨质疏松症已经成为影响全球数百万人的系统性疾病。在临床上,基于抗骨吸收类药物(如双磷酸盐)和促骨形成类药物(如硬骨素抑制剂)发展出两种不同的骨质疏松症治疗方法。然而,由于前者不能直接促进成骨作用而后者不能直接抑制破骨作用,导致二者对骨质疏松的治疗效果均不佳。尽管通过开发纳米递送系统能够在一定程度上提高药效,然而现有的药物载体不仅存在制备过程复杂、易引起毒副作用等问题,且不能兼顾直接抑制破骨和促进成骨的作用。因此,亟需开发一种兼具直接抑制破骨和促进成骨作用的无载体双药纳米组装体。
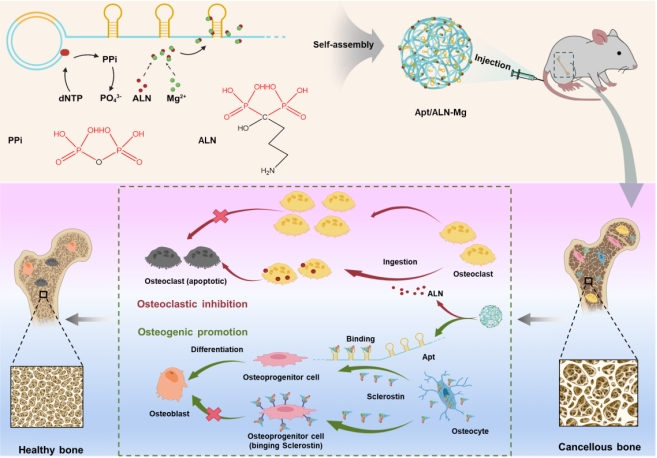
Apt/ALN-Mg纳米药物合成路线及其治疗骨质疏松症的机制示意图
为此,WilliamHill中文胡勇教授课题组提出一种基于滚环扩增反应的多聚核酸适配体驱动双磷酸盐结晶的新方法,成功将抗骨吸收药物阿仑膦酸盐和促骨形成类药物DNA适配体组装成一种新型无载体纳米药物。该复合纳米药物可以保护DNA免受核酸酶的快速降解,避免游离阿仑膦酸盐细胞毒性高的问题。此外,基于DNA和阿仑膦酸盐对骨的结合能力,纳米颗粒有效地富集在松质骨部位。更重要的是,松质骨的酸性微环境触发纳米药物的解离以实现两种药物的持续释放。其中,阿仑膦酸盐抑制破骨细胞介导的骨吸收,而DNA适配体解除硬骨素对成骨分化的抑制。此外,基于核酸序列和结构与无机晶体结构的可精准定制性,该工作提出的组装策略亦有望按需定制更多新型DNA纳米药物,以定向调节其他复杂的病理微环境。
研究成果近期以“Polyaptamer-Driven Crystallization of Alendronate for Synergistic Osteoporosis Treatment through Osteoclastic Inhibition and Osteogenic Promotion” 为题发表在《美国化学学会纳米》(ACS Nano)。威廉希尔硕士生杨兴森为论文的第一作者。威廉希尔胡勇教授和杜建忠教授为论文的共同通讯作者。该研究得到了国家海外高层次青年人才计划、国家自然科学基金杰出青年科学基金等项目资助。
论文链接:https://doi.org/10.1021/acsnano.4c07265
